|
Latvijas Zinātņu akadēmijaLatvian Academy of Sciences |
Zinātnes VēstnesisZinātnes Vēstnesis-202013.janvāris, 1(585) 27.janvāris, 2(586) 10.februāris, 3(587) 24.februāris, 4(588) 9.marts, 5(589) 23.marts, 6(590) 6.aprīlis, 7(591) 20.aprīlis, 8(592) 4.maijs, 9(593) 18.maijs, 10(594) 1.jūnijs, 11(595) 15.jūnijs, 12(596) 6.jūlijs, 13(597)Jaunākais ZV
|
KORONAVĪRUSI 6-03-2020
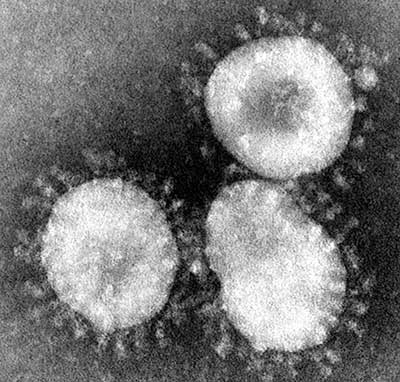
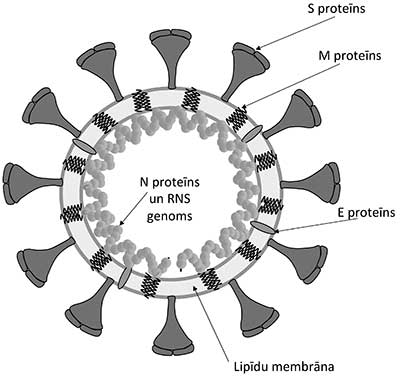
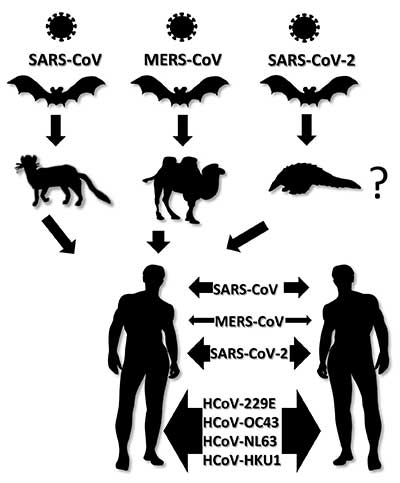
Koronavīrusu vispārējs raksturojums, morfoloģija un klasifikācija* Pēdējās divās desmitgadēs koronavīrusi ir vairākas reizes izraisījuši plašu sabiedrības uzmanību saistībā ar to izraisītajām smagajām saslimšanām - tādām kā SARS, MERS un tagad arī COVID-19 [1]. Koronavīrusi izraisa arī citas saslimšanas gan cilvēkiem, gan dzīvniekiem un to izpausmes mēdz būt ļoti dažādas - sākot no asimptomātiskām un beidzot ar letālām. Cilvēkiem koronavīrusi izraisa pārsvarā dažādas elpceļu saslimšanas. Dzīvniekiem tie var izraisīt arī gastrointestinālā trakta, uroģenitālā trakta, aknu un neiroloģiskas saslimšanas. Morfoloģiski, koronavīrusi veido neregulāras, aptuveni sfēriskas formas daļiņas, kuru izmērs variē no 80 līdz 120 nm. Elektronu mikroskopā ap daļiņām var saskatīt vainagam līdzīgu struktūru, kuru veido vīrusa membrānā ievietotie proteīni (1. attēls). Koronavīrusu nosaukums ir atvasināts no latīņu "corona", t.i. "kronis", "vainags". Koronavīrusi pieder pie Nidovirales vīrusu kārtas [2]. Visiem Nidovirales vīrusiem ir raksturīgs līdzīgs infekcijas cikls, kura laikā tiek producētas dažāda garuma sub-genomiskās mRNS. Koronavīrusiem ir vienpavediena kodējošās ķēdes RNS (+ssRNS) aptuveni 30 000 nukleotīdu garš genoms, kas ievērojami pārsniedz jebkura cita RNS vīrusa genoma izmēru. Viens no faktoriem, kas limitē citu RNS vīrusu genomu garumu ir lielais mutāciju skaits, kuras ievieš RNS polimerāzes, jo tām nav kļūdu labošanas mehānisma. Unikāli starp RNS vīrusiem, koronavīrusu un citu Nidovirales pārstāvju genoms kodē īpašu Nsp14 proteīnu, kurš palīdz labot RNS polimerāzes ieviestās kļūdas [3]. Tādejādi ierobežotais mutāciju skaits koronavīrusiem atļauj uzturēt daudz lielāku genomu nekā citiem RNS vīrusiem. Vienlaicīgi, nelielais mutāciju skaits nozīmē to, ka koronavīrusi nemainās tik ātri, kā citi RNS vīrusi - tādi, ka Hepatīta C vīruss vai influenza. Koronavīrusu genoms un uzbūve Pirmās divas trešdaļas no koronavīrusu genoma kodē divus poliproteīnus. Poliproteīni satur dažādu nestrukturālo proteīnu sekvences, tajā skaitā divas proteāzes. Proteāžu aktivitātes rezultātā poliproteīni tiek sašķelti 16 funkcionālās subvienībās, daudzas no kurām veido RNS polimerāzes kompleksu. Koronavīrusu genoma pēdējā trešdaļa, saukta par strukturālo rajonu, kodē visus strukturālos proteīnus un vēl dažus nestrukturālos proteīnus. Koronavīrusu nukleokapsīdu veido spirāliski izkārtotas nukleoproteīna (N proteīna) kopijas, kuras ietver RNS genomu [4] (2. attēls). Savukārt nukleokapsīdu ietver no inficētās šūnas aizgūts lipīdu apvalks, kurā ir ievietoti vairāki vīrusa strukturālie proteīni - S, M un E. S proteīns (angl. Spike - smaile, asums) veido raksturīgos izaugumus uz vīrusa virsmas, kuri ir labi saskatāmi elektronu mikroskopā. S proteīns ir atbildīgs par vīrusa daļiņas piesaistīšanos pie inficējamās šūnas virsmas receptoriem [5]. Dažādi koronavīrusi izmanto dažādus receptorus - piemēram, SARS-CoV un SARS-CoV-2 piesaistās pie angiotenzīnu konvertējošā enzīma-2 (ACE-2) [6, 7]. Koronavīrusu izraisītās dzīvnieku saslimšanas Koronavīrusi var izraisīt nopietnu apdraudējumu ne vien cilvēkiem, bet arī savvaļas un mājdzīvniekiem. Koronavīrusi ir ļoti bieži sastopami sikspārņiem, kuri ir saimniekorganismi arī SARS-CoV, MERS-CoV un jaunajam SARS-CoV-2. Koronavīrusi inficē arī daudzus citus dzīvniekus, piemēram, suņus [8], kaķus [9], cūkas [10], liellopus [11] un pat vaļus [12]. Koronavīrusi var nodarīt nopietnus ekonomiskos zaudējumus lopkopības nozarei. Piemēram, 2016. gadā Ķīnā notika cūku akūtās caurejas sindroma koronavīrusa uzliesmojums, kā rezultātā bojā gāja 24 000 cūkas [13]. Putnu infekciozā bronhīta vīruss IBV (angl. Infectious bronhitis virus) var nodarīt būtisku kaitējumu putnkopības nozarē [14]. Koronavīrusu izraisītās cilvēku saslimšanas Šobrīd ir zināmi 7 dažādi cilvēku koronavīrusi. Četri no tiem - HCoV-229E, HCoV-OC43, HCoV-NL63 un HCoV-HKU1 cilvēkos izraisa aptuveni 5-15% no parastās saaukstēšanās gadījumiem. Lielākajā daļā gadījumu saslimšana ir viegla un simptomi ir līdzīgi biežāk sastopamo rinovīrusu izraisītajām iesnām [15]. Trīs zoonotiskas izcelsmes koronavīrusi SARS-CoV, MERS-CoV un SARS-CoV-2 cilvēkiem var izraisīt nopietnu, dzīvību apdraudošu saslimšanu. Visticamāk, visi trīs zoonotiskie vīrusi līdz cilvēkiem ir nonākuši no sikspārņiem pastarpināti caur citiem dzīvniekiem (3. attēls). SARS-CoV izraisa smagā akūtā respiratorā sindroma (SARS) saslimšanu, kuras uzliesmojums bija 2002.-2003. gadā [16], galvenokārt Ķīnā un Honkongā, bet kopš 2004. gada jauni saslimšanas gadījumi nav konstatēti. Kopumā tika reģistrēti 8096 pacienti, no kuriem nomira 774, tātad mirstība bija nedaudz zem 10 %[17]. Vēlākajos pētījumos tika noskaidrots, ka vīrusu cilvēkiem varētu būt nodevuši sikspārņi [18] pastarpināti caur citiem savvaļas dzīvniekiem Ķīnas gaļas tirgos. Kā iespējamie starpsaimnieki tika identificētas maskotās palmu civetas [19] - nelieli kaķveidīgie, kuru gaļu mēdz lietot uzturā kā delikatesi Ķīnas un Dienvidaustrumu Āzijas iedzīvotāji. MERS-CoV izraisa Vidējo Austrumu respiratorā sindroma MERS (angl. Middle East respiratory syndrome) saslimšanu, kura pirmo reizi parādījās Sauda Arābijā 2012. gadā [20] un ir aktuāla joprojām - 2019. gadā tika konstatēti 199 jauni saslimšanas gadījumi [21]. Simptomi ir līdzīgi SARS, bet mirstība ir ievērojami augstāka - virs 35%. Tomēr, MERS vīrusa pārnešana starp cilvēkiem notiek samērā neefektīvi, pārsvarā gadījumu ciešos kontaktos ar smagi saslimušu pacientu [22]. Līdzīgi SARS-CoV, arī MERS CoV visticamākais primārais avots ir sikspārņi [23]. Uz MERS-CoV vēl vienu izcelsmes avotu norāda vīrusa otrs nosaukums "kamieļu gripa" (angl. camel flu). Visticamāk, cilvēkiem MERS-CoV no sikspārņiem ir nodots pastarpināti caur kamieļiem [24]. Jaunais SARS-CoV-2 (sākotnēji zināms kā 2019-nCoV) izraisa COVID-19 (angl. Coronavirus disease 2019) saslimšanu. Kā liecina nosaukums, SARS-CoV-2 ir cieši radniecīgs SARS-CoV, abi vīrusi ir aptuveni 80% identiski [25]. SARS-CoV-2 var tikt samērā efektīvi pārnests no viena cilvēka uz otru. Kopējais saslimušo skaits līdz 17.02.2020 pārsniedza 70 000 un mirušo skaits bija ap 1800. Gan inficēto, gan mirušo skaits jau tagad ievērojami pārsniedz SARS 2002.-2003. gadu epidēmijas rādītājus. Tomēr, procentuāli mirstība no SARS-CoV-2 ir ievērojami zemāka - saskaņā ar pašreizējiem novērtējumiem aptuveni 3% [26]. Vīruss uz cilvēkiem no sikspārņiem [27] varētu būt izplatījies caur kādu starpsaimnieka organismu Uhaņas tirgū. Sākotnējais paziņojums par čūskām, kā iespējamo SARS-CoV-2 avotu nav pārāk ticams un ir balstīts uz ļoti netiešiem pierādījumiem, pamatojoties uz vīrusa aminoskābju kodonu lietojumu, kurš bija līdzīgs, kā čūsku genomā [28]. Vēlāk parādījās ziņas par diviem pētījumiem, kuri liecināja, ka vīruss varētu būt izplatījies no pangolīniem [29, 30], kurus izmanto ķīniešu tradicionālajā medicīnā. Iespējas zāļu un vakcīnu radīšanai Šobrīd komerciāli nav pieejamas efektīvas zāles ne pret vienu no koronavīrusiem. Pēc SARS un MERS uzliesmojumiem pētnieki ir pastiprināti pievērsušies efektīvu zāļvielu izstrādei. Kā piemēru var minēt Gilead Sciences preparātu, nukleozīdu analogu GS-5734 "Remdesivir", kurš ir efektīvs pret vairākiem koronavīrusiem [31]. Aktivitāti pret koronavīrusiem (ieskaitot SARS-CoV-2) šūnu kultūrās ir uzrādījuši arī pretmalārijas preparāts hlorokīns [31] un pret-AIDS preparāts, proteāzes inhibitoru kokteilis Lopinavir/ritonavir [32]. Tomēr, šobrīd cilvēku klīniskajos pētījumos vēl nav apstiprināta neviena preparāta efektivitāte. Ne pret vienu no cilvēkus inficējošiem koronavīrusiem nav pieejama vakcīna. Samērā aktīva darbība notiek MERS vakcīnas izstrādē. Šobrīd vairāki desmiti MERS vakcīnu kandidātu ir dažādās izstrādes stadijās. Daži kandidāti ir sasnieguši agrīnās klīnisko pētījumu stadijas - piemēram ASV un Dienvidkorejas pētnieku izstrādātā DNS vakcīna GLS-5300 [33]. Tomēr, pat visveiksmīgākā scenārija gadījumā paies vairāki gadi līdz MERS vakcīnas pieejamībai tirgū. Vakcīnu izstrāde pret jauno SARS-CoV-2 ir uzsākta ļoti nesen, tādejādi publicētu datu šobrīd vēl ir ļoti maz. Par vakcīnas izstrādes uzsākšanu ir paziņojušas vairākas pētnieku grupas un farmaceitiskās firmas, tajā skaitā Johnson & Johnson un GlaxoSmithKline. Šobrīd ir izstrādāti un komerciāli pieejami vairāki desmiti veterināro vakcīnu pret dažādiem koronavīrusiem, tajā skaitā pret daudziem putnu IBV serotipiem [34], suņu CCoV [35] un vairākiem cūku koronavīrusiem [36]. Ņemot vērā ievērojamo dažādo veterināro vakcīnu skaitu un plašo pielietojumu, ir nedaudz pārsteidzoši, ka līdzīgas vakcīnas nav radītas arī lietošanai cilvēkiem. Te gan jāņem vērā, ka lielākā daļa efektīvo veterināro vakcīnu ir atenuēti, bet dzīvi vīrusi. Analogas vakcīnas izstrāde pret SARS, MERS, vai COVID-19 būtu saistīta ar ievērojamiem drošības riskiem gan saistībā ar vakcīnu ražošanu, gan iespēju, ka atenuētais vīruss varētu revertēties uz virulento formu. Noslēgumam Koronavīrusi ir plaši sastopami gan cilvēkiem, gan dzīvniekiem un var izraisīt gan vieglas, gan arī ļoti smagas un pat letālas saslimšanas. Kopš 2003. gada cilvēkus inficējošo koronavīrusu skaits ir pieaudzis no 2 līdz 7 un, visticamāk, līdzīga tendence turpināsies arī nākotnē. Lai nodrošinātos pret globālas pandēmijas riskiem, būtu nepieciešams izstrādāt efektīvas zāļvielas un vakcīnas. Dr.biol. Kaspars Tārs, LZA akadēmiķis Literatūra 1. McIntosh, K. Coronaviruses. UpToDate 2020; Available from: https://www.uptodate.com/contents/coronaviruses. 2. International Committee on Taxonomy of Viruses ICTV. Available from: https://talk.ictvonline.org/taxonomy/. 3. Eckerle, L.D., et al., High fidelity of murine hepatitis virus replication is decreased in nsp14 exoribonuclease mutants. J Virol, 2007. 81(22): p. 12135-44. 4. McBride, R., M. van Zyl, and B.C. Fielding, The coronavirus nucleocapsid is a multifunctional protein. Viruses, 2014. 6(8): p. 2991-3018. 5. Collins, A.R., et al., Monoclonal antibodies to murine hepatitis virus-4 (strain JHM) define the viral glycoprotein responsible for attachment and cell--cell fusion. Virology, 1982. 119(2): p. 358-71. 6. Li, W., et al., Angiotensin-converting enzyme 2 is a functional receptor for the SARS coronavirus. Nature, 2003. 426(6965): p. 450-4. 7. Xu, X., et al., Evolution of the novel coronavirus from the ongoing Wuhan outbreak and modeling of its spike protein for risk of human transmission. Sci China Life Sci, 2020. 8. Decaro, N. and C. Buonavoglia, An update on canine coronaviruses: viral evolution and pathobiology. Vet Microbiol, 2008. 132(3-4): p. 221-34. 9. Tekes, G. and H.J. Thiel, Feline Coronaviruses: Pathogenesis of Feline Infectious Peritonitis. Adv Virus Res, 2016. 96: p. 193-218. 10. Wang, Q., et al., Emerging and re-emerging coronaviruses in pigs. Curr Opin Virol, 2019. 34: p. 39-49. 11. Amer, H.M., Bovine-like coronaviruses in domestic and wild ruminants. Anim Health Res Rev, 2018. 19(2): p. 113-124. 12. Mihindukulasuriya, K.A., et al., Identification of a novel coronavirus from a beluga whale by using a panviral microarray. J Virol, 2008. 82(10): p. 5084-8. 13. Zhou, P., et al., Fatal swine acute diarrhoea syndrome caused by an HKU2-related coronavirus of bat origin. Nature, 2018. 556(7700): p. 255-258. 14. Bande, F., et al., Global distributions and strain diversity of avian infectious bronchitis virus: a review. Anim Health Res Rev, 2017. 18(1): p. 70-83. 15. Greenberg, S.B., Update on Human Rhinovirus and Coronavirus Infections. Semin Respir Crit Care Med, 2016. 37(4): p. 555-71. 16. Peiris, J.S., et al., Coronavirus as a possible cause of severe acute respiratory syndrome. Lancet, 2003. 361(9366): p. 1319-25. 17. Summary of probable SARS cases with onset of illness from 1 November 2002 to 31 July 2003. Available from: https://www.who.int/csr/sars/country/table2004_04_21/en/. 18. Ge, X.Y., et al., Isolation and characterization of a bat SARS-like coronavirus that uses the ACE2 receptor. Nature, 2013. 503(7477): p. 535-8. 19. He, Y., et al., Cross-neutralization of human and palm civet severe acute respiratory syndrome coronaviruses by antibodies targeting the receptor-binding domain of spike protein. J Immunol, 2006. 176(10): p. 6085-92. 20. Zaki, A.M., et al., Isolation of a novel coronavirus from a man with pneumonia in Saudi Arabia. N Engl J Med, 2012. 367(19): p. 1814-20. 21. MERS-CoV worldwide overview. Situation update, 6 December 2020. European Centre for Disease Prevention and Control 2020; Available from: https://www.ecdc.europa.eu/en/middle-east-respiratory-syndrome-coronavirus-mers-cov-situation-update. 22. Middle East respiratory syndrome coronavirus (MERS-CoV). Available from: https://www.who.int/en/news-room/fact-sheets/detail/middle-east-respiratory-syndrome-coronavirus-(mers-cov). 23. Middle East respiratory syndrome coronavirus (MERS-CoV) - Republic of Korea. Available from: https://www.who.int/csr/don/25-october-2015-mers-korea/en/. 24. Reusken, C.B., et al., Middle East respiratory syndrome coronavirus neutralising serum antibodies in dromedary camels: a comparative serological study. Lancet Infect Dis, 2013. 13(10): p. 859-66. 25. Benvenuto, D., et al., The 2019-new coronavirus epidemic: Evidence for virus evolution. J Med Virol, 2020. 26. Wang, C., et al., A novel coronavirus outbreak of global health concern. Lancet, 2020. 395(10223): p. 470-473. 27. Zhou, P., et al., A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature, 2020. 28. Ji, W., et al., Homologous recombination within the spike glycoprotein of the newly identified coronavirus may boost cross-species transmission from snake to human. J Med Virol, 2020. 29. Cyranoski, D. Did pangolins spread the China coronavirus to people. Nature News 07 February 2020; Available from: Did pangolins spread the China coronavirus to people. 30. Wong, M., C., et al. Evidence of recombination in coronaviruses implicating pangolin origins of nCoV-2019. 2020. 31. Wang, M., et al., Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro. Cell Res, 2020. 32. Chu, C.M., et al., Role of lopinavir/ritonavir in the treatment of SARS: initial virological and clinical findings. Thorax, 2004. 59(3): p. 252-6. 33. Modjarrad, K., et al., Safety and immunogenicity of an anti-Middle East respiratory syndrome coronavirus DNA vaccine: a phase 1, open-label, single-arm, dose-escalation trial. Lancet Infect Dis, 2019. 19(9): p. 1013-1022. 34. Bande, F., et al., Progress and challenges toward the development of vaccines against avian infectious bronchitis. J Immunol Res, 2015. 2015: p. 424860. 35. Decaro, N., et al., Immunogenicity and protective efficacy in dogs of an MF59-adjuvanted vaccine against recombinant canine/porcine coronavirus. Vaccine, 2011. 29(11): p. 2018-23. 36. Gerdts, V. and A. Zakhartchouk, Vaccines for porcine epidemic diarrhea virus and other swine coronaviruses. Vet Microbiol, 2017. 206: p. 45-51. * Detalizētāka raksta versija publicēta žurnāla "Latvijas Ārsts" 2020. gada marta numurā
|